Thomas Morzadec
Nicolas Coustaury
Avit Guirimand
Quels sont les obstacles au
developpement de la pile à hydrogène ?

Thomas Morzadec
Nicolas Coustaury
Avit Guirimand
Quels sont les obstacles au
developpement de la pile à hydrogène ?
Il existe de nombreux types de piles à combustible mais seulement 6 sont véritablement connus :
- PEMFC (Polymer Exchange Membran Fuel Cell),
- AFC (Alkaline fuel Cell),
- MCFC (Molten carbonate Fuel Cell),
- DMFC (Direct Methanol Fuel Cell),
- PAFC (Phosphoric Acid Fuel Cell),
- SOFC (Solid Oxid Fuel Cell).
Les différences entre ces types de piles sont :
- leurs températures de fonctionnement (de 60 à 1000°C!!),
- leurs matériaux de construction (électrolytes notament),
- la pureté de l'hydrogène que l’on doit utiliser (sauf pour la DMFC où on utilise du méthanol).
D'où des applications très différentes.
Aujourd’hui la plus répandue reste la PEMFC. C’est aussi la plus prometteuse et celle sur laquelle ils y a le plus d’équipes de chercheurs qui travaillent. C’est celle qui semble être capable d’aboutir le plus rapidement. Ses applications principales pour le moment sont les transports et principalement l’automobile. Nous nous limiterons à l’étude de ce type de pile.

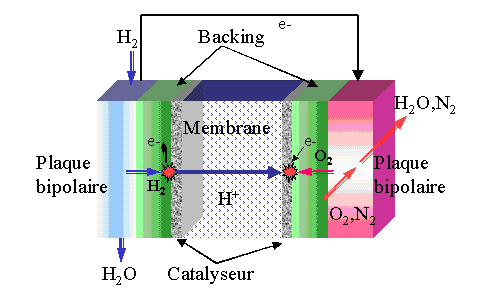
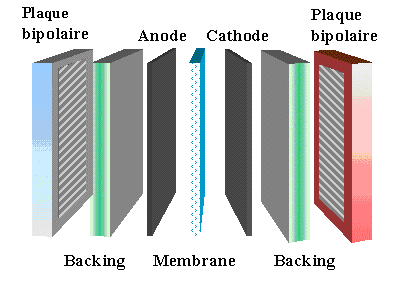
Vue d’ensemble !
Les différents composants de la pile:
Membrane
Electrodes
Backings
Plaques bipolaires
Les électrolytes sont différents d’une pile à l’autre : ils peuvent être dans des divers états et dans des matériaux variés (Par exemple, dans les piles AFC (pour applications aérospatiales), l'électrolyte est liquide. Dans la PEMFC il est solide : cela évite la "noyade" des électrodes en cas d'excès et leur assèchement. C’est en fait un polymère ionique acide : sa particularité est l’ajout de groupements acides sulfonates SO3- ou COOH.
Le modèle référence est le Nafion ( créé par la firme Du Pont de Nemours ). Il existe des concurrents.
Dans ce type d'électrolytes, les ions négatifs sont retenus à l’entrée de la membrane. Seuls les ions hydrogène H+ sont mobiles et libres de transporter la charge positive à travers la membrane, de l'anode vers la cathode.C’est ce mouvement qui créé le courant. La conductivité ionique de la membrane dépend de la température, de la concentration en groupe acide et et de l'hydratation de la membrane: celle ci permet d’optimiser le déplacement d’ions : elle doit rester saturée d'eau pour permettre le déplacement des ions H+. Des recherches ont été faite afin qu’elle soit la plus grande possible.
Voici sa formule chimique pour les amateurs de chimie :
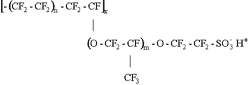
Structure de la membrane Nafion
Autre propriété de la membrane: elle doit séparer efficacement les gaz:
En effet l’hydrogène est le gaz le plus petit qui existe et il est inflammable. De plus, si le dioxygène de l’air entrait en contact avec la cathode ou l’anode, cela risquerait de produire du monoxyde de carbone (CO) qui est très toxique. L’azote peut aussi transpercer les membranes. Le rendement de la pile dépend de cette étanchéité.
Enfin, les électrons ne doivent pas pouvoir franchir la membrane.
Les conditions de fonctionnement sont :
- La pression (entre 1 et 5 bars)
- la température (entre 60 et 90°C)
- l'humidité.
Ces conditions sont nécessaires pour la stabilité et la résistance. Mais elles ne doivent pas dépasser cette fourchette. La gestion de l’humidité reste une difficulté (trop sèche = rupture ; la pile produit de l’eau qui doit être évacuée) . Ces membranes ont une épaisseur entre 50 et 200 µm (1 µm = 1/1000 de millimètre) .
Des recherches sont en cours afin d'augmenter la température de fonctionnement vers 160 - 180°C. L’avantage serait de pouvoir récupérer l’énergie thermique et d’accélérer les réactions tout en évitant la création de gaz toxique. Une solution serait de remplacer le nafion par une membrane plus performante.( le CEA travaille sur des membranes polyimides sulfonées)
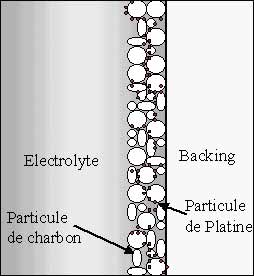
Schéma d'une électrode
Les électrodes (anode et cathode) sont composées de carbone dans lequel est ajouté du platine (0,1 à 1 mg/cm2). D’autres métaux précieux sont aussi ajoutés en petite quantité. Les électrodes servent à "casser" l'hydrogène et à catalyser le transfert des protons vers l'électrolyte.
A l'anode, l'hydrogène diffuse à travers le matériau jusqu'à ce qu'il rencontre une particule de platine. Sous l'action du catalyseur, la molécule d'hydrogène se scinde en deux atomes d'hydrogène. Ceux ci forment alors une liaison avec deux atomes de platine, puis chacun se scinde en un électron et un proton H+ qui pourra alors traverser la membrane de l'anode vers la cathode :
Réaction qui se produit à l'anode
Les réactions précédentes se font en présence du catalyseur Platine: la première est une étape longue d'adsorption et de dissociation.
A la cathode, on utilise aussi des catalyseurs à base de platine. Le mécanisme de réaction est là aussi assez complexe (étapes multiples):
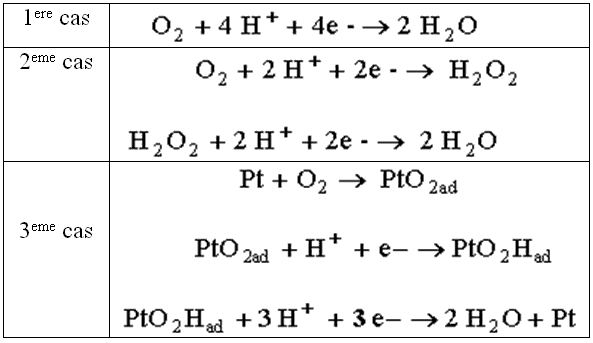
Les Backings sont situés autour des électrodes (voir schéma). Ils ont une épaisseur de 100 à 300 µm. Ils servent à diffuser des gaz jusqu'aux électrodes et à transférer des électrons de l'anode vers la cathode. C’est pourquoi ils sont conducteurs et poreux. La diffusion est nécessaire pour que les gaz se répartissent sur toute la membrane. Ils sont indispensable à la gestion de l’eau (humidification de l’électrolyte ) et évacuation)
Different materiaux de fabrication sont possible : du graphite haute densité (le plus souvent) ou des mousses métalliques.
Elles servent à :
- distribuer des gaz
- l'évacuer de l'eau:
Pour cela, l'une des faces est parcourue de petit canaux de 0,8 mm. Mais ce sont aussi des collecteurs de courant. Les électrons produits par l'oxydation de l'hydrogène (réaction à l’anode) traversent l'anode puis la plaque, passent par le circuit extérieur (là ou l’on a besoin de courant ! ) et arrivent du côté de la cathode. Les différents éléments électrodes-membrane sont connectés les uns aux autres par l'intermédiaire de ces plaques (les plaques positives étant au contact des plaques négatives). A ces plaques il faut rajouter deux plaques terminales à chaque extrémité de la pile. Ainsi on peut ajouter autant de « modules » électrodes-membranes que l’on en a besoin.

Représentation d'une plaque avec des micro canaux
Elles doivent présenter une bonne stabilité face aux réactions, notamment par rapport à l'eau et aux acides (pour ne pas s’abimer) ainsi qu'une très faible perméabilité à l'hydrogène (cela est très dur car l’hydrogène est un gaz extrêmement fin) . Parallèlement, cet ensemble doit être léger afin de limiter le poids total de la pile.
La qualité des canaux est déterminante pour assurer de bonnes performances. Le graphite doit être usiné avec soin. La fabrication est donc délicate et coûte cher. Les recherches sont en cours sur l’utilisation de matériaux autres que le graphite (inox, résines thermodurcissables) et l’amélioration des procédés de fabrication.